はじめに
細胞診は小動物診療においてきわめて有用な検査である。細胞診は直ちに結果がわかり、経済性も高く、かつ安全であるという点で優れた検査である。診療室で患者が待っている間に結果が出せるので、その場で診断名を伝えたり、あるいは最終的な診断名が出せないまでも治療の方向性や今後必要な検査を決定したりする事ができる。このため、ぜひ身につけて頂きたい検査手法である。
リハビリテーションを行う前の機能評価法
1.サンプル採取
a.スタンプ
病変部が体表にある場合、あるいは外科的に摘出された材料の場合にはスタンプ標本を作製することができる。摘出材料をスタンプする場合は、表面の血液をペーパータオルなどで十分拭って(図1A)からスタンプする(図1B)。病変部にカバーグラスやスライドグラスを押し当ててスタンプする場合、細菌による二次感染病変や炎症性変化しか見られないことがあるが、このような場合は病変部表面を生理食塩水などできれいにしてからスタンプするようにする。潰瘍性病変の場合は、まずそのままスタンプし、病変部をきれいにしてからもう一度スタンプするようにする。表面が血液や漿液でぬれたままスタンプすると、当然のことながら血液細胞のみの診断的価値のない標本となる。
b.掻爬
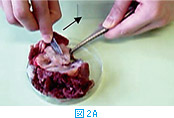
メスの刃で摘出組織の病変部を掻爬して得られたサンプルで標本を作製する方法である。組織の割面をメスの刃で手前に引くように数回こする(図2A)。次いで、図2Bに示す様に刃先の反対側から手前に引くようにスライドグラスにこすりつけ、メスの刃の刃先に付いた組織をスライドグラスに塗り付ける。病変部が硬く、あまり細胞がとれないような場合には良い方法であるが、表面の細胞しかとれないという欠点はスタンプと同様である。
c.綿棒による細胞採取
他の方法ではサンプル採取が行いにくい部位の採材に用いられる。例えば、腟や瘻管からのサンプリングである。サンプル採取部位が非常に湿り気を帯びている場合を除いて、生理食塩水で綿棒を湿らせてから採材するようにする。スライドグラスに塗布する時は綿棒を軽く押しつけるか転がすようにし、絶対にこすりつけないようにする。このようなちょっとしたことで細胞の壊れ方が違ってくる。
d.針吸引生検
臨床的に最も頻繁に行われる方法が、この針吸引生検(Fine needle aspirationの省略でFNAと呼ばれる事が多い)である。吸引には通常23Gの注射針と5mlのディスポーザブルシリンジで十分である。21Gよりも太い針を用いることはほとんどなく、かえって血液の混入率が高くなりよくない。
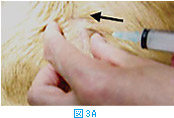
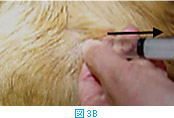
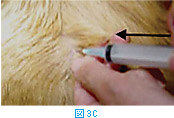
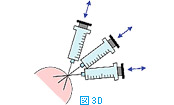
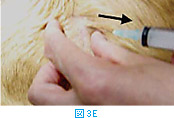
体表腫瘤の針吸引生検では、注射針を腫瘤に差込み(図3A)、数回吸引を繰り返す(図3BおよびC)。その後、針の方向を変えて同様に何方向からか吸引する(図3D)。針を抜く際には陰圧をかけない状態にしておく(図3E)。陰圧をかけたまま抜くと、針の中のサンプルがシリンジやハブの中に入り、回収が困難となる。吸引生検を行う組織によっては全く陰圧をかける必要がないこともある(シリンジを使わず針のみを用いる)。リンパ節などは、方向を少しずつかえて何回か針を刺すだけで十分な量の細胞が採取できることが多い。
体腔内の組織や腫瘤に対しても針吸引生検は有効である。おとなしい動物では、鎮静や麻酔なしでも針吸引生検を実施することができる。体腔内の組織や腫瘤の針吸引生検を行う際は超音波ガイド下で行う(図4A)。標的とする病変部や腫瘤を描出し、プローブの横から針を刺入する(図4B)。病変部を確認する際は超音波検査用のジェルを用いるが、標的部位を確認し、穿刺を行う時には一旦プローブをはずして、プローブと皮膚に付着したジェルを丁寧に拭き取る必要がある。これは、そのまま穿刺すると皮膚などに付着したジェルが針の中に入ってしまし、細胞を破壊してしまうためである。図4Cにジェルが混入した場合の細胞診標本を示した。
矢印で示したピンクの粒状不定形構造物がジェルであり、細胞は一度ジェルに触れると壊れてしまう(矢頭)。ジェルの混入が多い標本は評価が不能となることが多い。穿刺の際には、アルコールで皮膚を湿らせただけでプローブをあて、超音波画像を描出する。
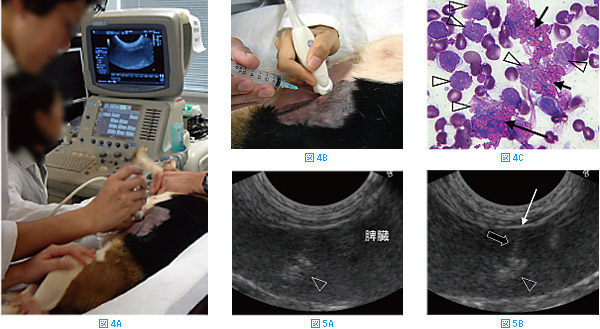
図5は脾臓内の不整構造物(矢頭)を穿刺する際の超音波画像を示した。標的となる構造物を描出し(図5A)、次いで針を刺入する(図5B、白矢印)。針は超音波画像で高エコーのライン(図5B、黒矢印)または点として描出されるので、針が標的部位に入ったことを確認してから吸引する。吸引の要領は体表腫瘤の場合と同様であるが、針の向きを変えて何度も刺すことはせず、一方向のみで行う。また、血液の混入が多い場合や動物が動く場合は、シリンジを使用せず、針のみを用いて穿刺するとよい。
体腔内の組織や腫瘤の針吸引生検を行う場合、あらかじめカラードップラーを用いて血管走行を確認するとよい。太い血管が標的部位近くを走行していたり、血管が多数入り込んでいたりする場合は針吸引生検を中止するかあるいは慎重に行う必要がある。また、超音波画像所見などから明らかに脾臓の血管肉腫が疑われる場合は、穿刺による腹腔内出血を引き起こす可能性が高いため、針吸引生検を行うべきではない。
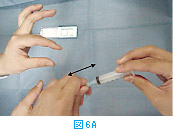
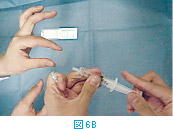
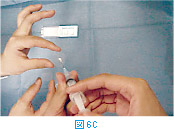
塗抹標本の作製は、サンプル採取後直ちに行う。採取したサンプルは注射針の中に入っているので、一度シリンジをはずし(図6A)、そのシリンジに空気を吸って(図6B)から再度針を装着する。この状態から、スライドグラスあるいはカバーグラス上にやさしくサンプルを吹き出し(図6C)塗抹標本を作製する(2.塗抹標本の作製方法を参照)。
e.貯留液の細胞診
胸水や腹水あるいはその他の貯留液の細胞診を行う場合は、まず採取した液体をそのままスライドグラスあるいはカバーグラスに塗抹する(2 塗抹標本の作製方法を参照)。その後、1000-1500rpmで1-2分遠心し、上清を回収する。上清は比重や蛋白量の測定に用いる。チューブに残った沈渣はチューブの底の方を軽くたたいて懸濁し、その懸濁液を同様に塗抹する。貯留液の細胞診行う場合、沈渣した標本と沈渣していない標本の両方を評価する必要がある。このため沈渣しない塗抹標本を、分遠心する前に忘れずに作製しておく必要がある。
2.塗抹標本の作製方法
針吸引生検および液体の細胞診ではサンプルの採取後に塗抹標本を作製する。塗抹標本の作製は通常の血液塗抹標本と同様の方法で行うことができるが、サンプル中に固形物が含まれているような場合は、ガラスを指で圧迫し、固形物を押しつぶしてから標本の作製を行う。この時、強く押しすぎて細胞を壊さないように注意する。
塗抹標本の作製方法はいくつかあるが、コンスタントにきれいな標本が作ることができればどの方法でも構わない。基本的にはスライドグラスを使う方法とカバーグラスを使う方法に分けられる。スライドグラスを使う場合、脱脂済みのものはそのまま使えるが、そうでないものについては塩酸アルコールなどに浸漬しておき、使う前にキムワイプやガーゼでよく拭かなければならない。カバーグラスはそのまますぐに使える。カバーグラスのサイズは24x24mmのものが使い易い。
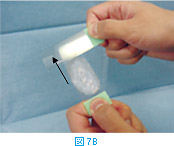
カバーグラスを使う方法は引き離し法と呼ばれるもので、針吸引生検ではカバーグラスの上にサンプルを吹き出し、液体の細胞診では液体あるいは沈渣の懸濁液を垂らす。その上にもう1枚のカバーグラスをのせ、2枚のカバーグラスを水平に引き離す(図7A)。この時、絶対に上下に引き離してはいけない。スライドグラスを用いる方法には、2枚のスライドグラスを平行あるいは直角に重ね合わせ(図7B)水平に引き離す。作製した塗抹標本は手早く風乾する。手でふってもよいし、冷風ドライヤーで乾わかしてもよい。この際、息を吹きかけて乾かしたり、温風ドライヤーを用いて乾かしたりしてはいけない。
3.染色
血液塗抹標本の染色には、通常、ロマノフスキータイプの染色が用いられる。これには、ヘマカラー染色、ライト染色、ギムザ染色あるいはライトギムザ染色のような重染色がある。ヘマカラー染色や他の簡易染色では染色液を繰り返し使うことになるので、定期的に交換するなどの注意が必要である。また、キットに入っている洗浄用の緩衝液による洗浄だけでは不十分なので、流水でよく洗う。標本上にゴミが付着していると、ヘモバルトネラなどの診断が難しくなる。上述の染色法の中ではライトギムザ染色が最もきれいに染色できるが、簡易染色でもコツをつかみ、染色液をこまめに換えれば、きれいな標本を作ることができる。ライトギムザ染色の簡単な方法を紹介しておく(図8)。

4.封入
スライドグラスで標本を作製した場合は封入せずにそのままでも観察可能であるが、カバーグラスの場合は封入しないと観察できない。また、標本を永久保存する場合は、封入したほうが保存性にすぐれている。封入のもう一つの利点は、40xの対物レンズを使用した時にピントが合うことである。封入はビオライトなどの封入剤を用いるが、かたすぎて使いにくい場合はキシロールを加えて適当なかたさに調節する。この時、目に見えない気泡ができるので、混和後1-2日おいてから使うようにする。毎日、検査室で使う分は蓋のついたガラス容器を用意し、乾いたりゴミが入ったりしないようにする。
スライドグラスに封入剤を1滴置き、気泡が入らないように注意しながら、カバーグラスを静かにのせればよいのであるが、この時、カバーグラスをキシロールに一度浸してから用いるときれいに封入できる。
カテゴリから探す